Pergeseran
Kesetimbangan
FASE ORIENTATION
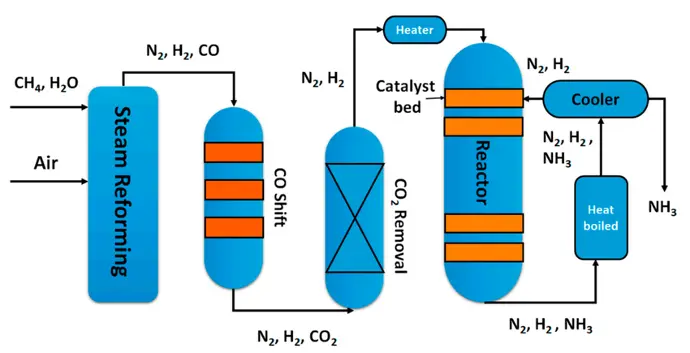
Salah satu tujuan utama dari sintesis kimia adalah untuk memaksimalkan pembentukan produk dan meminimalisir pengeluaran energi. Hal tersebut dapat terjadi jika reaksi dapat cepat selesai pada suhu dan tekanan normal. Tetapi banyak reaksi yang berjalan lambat pada suhu dan tekanan normal sehingga reaksi tersebut memberikan campuran kesetimbangan yang kaya reaktan dan menghasilkan sedikit produk. Jika kondisi tersebut terjadi, harus dilakukan penyesuaian agar produk yang dihasilkan tetap optimal. Prinsip kesetimbangan banyak dimanfaatkan dalam industri, contohnya yaitu prinsip kesetimbangan digunakan dalam produksi ammonia yang dilakukan dengan proses Haber Bosch dalam pabrik urea. Prinsip kesetimbangan ini dilakukan untuk memaksimalkan produksi ammonia. Bagaimanakah prinsip kesetimbangan ini dimanfaatkan untuk menghasilkan produk yang optimal?
Amonia merupakan salah satu bahan dasar pembuatan pupuk yang dapat diproduksi dengan proses Haber-Bocsh dengan persamaan reaksi:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Ketika dilakukan pada suhu kamar, reaksi tersebut berjalan sangat lambat sehingga hasil yang dihasilkan kurang optimal. Setelah dianalisis reaksi tersebut merupakan reaksi eksoterm. Sehingga perusahan melakukan upaya untuk mempercepat reaksi dengan menggunakan tekanan yang tinggi. Untuk mendapatkan hasil produksi secara optimal, perlu dilakukan pengupayaan agar yang mendukung reaksi kesetimbangan bergeser ke arah produk. Upaya apa saja yang dapat dilakukan untuk mendapatkan hasil produk amonia yang optimal?
FASE POSE QUESTION
Buatlah pertanyaan mengenai faktor yang memengaruhi kesetimbangan dan pergeseran kesetimbangan dalam kesetimbangan kimia yang akan kalian selidiki jawabannya!
Contoh : Bagaimana penambaha perubahan tekanan menjadi lebih tinggi dapat meningkatkan produksi amonia?
Fase Plan
1. Buatlah kelompok beranggotakan 4-5 orang
2. Diskusikan rencana penyelidikan untuk menjawab pertanyaan-pertanyaan setiap anggota kelompok dalam pose question.
4. Pahami langkah kerja pengamatan yang terdapat dalam LKPD dalam fase analisis.
6. Buatlah lembar pengamatan untuk mencatat hasil penyelidikan
Fase Execute
Lakukan penyelidikan sesuai dengan rencana yang telah dibuat pada fase plan (Lakukan pengamatan berdasarkan langkah kerja yang sudah kamu pahami).
Tuliskan hasil penyelidikanmu dalam tabel pengamatan. Penyelidikan diharapkan dapat menjawab pertanyaan pemantik utama di bawah ini:
1. Apa pengaruh konsentrasi pada pergeseran kesetimbangan?
2. Apa pengaruh perubah volume pada pergeseran kesetimbangan?
Dalam pembelajaran mandiri, dapat menonton video praktikum berikut untuk proses penyelidikan.
Dalam pembelajaran mandiri, dapat menonton video praktikum berikut untuk proses penyelidikan.
Lakukan pula percobaan dalam virtual lab di bawah ini .
1. Klik main
2. Klik Praktikum
FASE ANALYZE
Lakukan analisis terhadap data tersebut. Kemudian buatkan pembahasan dan kesimpulan sesuai dengan data yang telah didapatkan. Masukkan jawaban-jawabanmu dari pose question hingga analyze ke dalam lembar kerja di bawah ini!
FASE PRESENT FINDING
1. Buatlah ppt berisi pertanyaan, penyelidikan, hasil analisis, dan kesimpulan. Lakukan pula perluasan materi melalui kajian pustaka menganai 4 faktor yang mempengaruhi pergeseran kesetimbangan.
2. Salah satu kelompok melakukan presentasi di depan kelas
3. Lakukan diskusi dan tanya jawab antar kelompok
4. Kerjakan latihan-latihan soal berupa games di bagian bawah page ini dan klik back to course untuk latihan soal lainnya.
Tontonlah video berikut dan bacalah penguatan untuk memperkuat konsep kimia. Kemudian tanyakan pada guru jika ada materi yang belum 'dipahami ya chemist!
1. Buatlah ppt berisi pertanyaan, penyelidikan, hasil analisis, dan kesimpulan. Lakukan pula perluasan materi melalui kajian pustaka menganai 4 faktor yang mempengaruhi pergeseran kesetimbangan.
2. Salah satu kelompok melakukan presentasi di depan kelas
3. Lakukan diskusi dan tanya jawab antar kelompok
4. Kerjakan latihan-latihan soal berupa games di bagian bawah page ini dan klik back to course untuk latihan soal lainnya.
Tontonlah video berikut dan bacalah penguatan untuk memperkuat konsep kimia. Kemudian tanyakan pada guru jika ada materi yang belum 'dipahami ya chemist!
1. Buatlah ppt berisi pertanyaan, penyelidikan, hasil analisis, dan kesimpulan. Lakukan pula perluasan materi melalui kajian pustaka menganai 4 faktor yang mempengaruhi pergeseran kesetimbangan.
2. Salah satu kelompok melakukan presentasi di depan kelas
3. Lakukan diskusi dan tanya jawab antar kelompok
4. Kerjakan latihan-latihan soal berupa games di bagian bawah page ini dan klik back to course untuk latihan soal lainnya.
Tontonlah video berikut dan bacalah penguatan untuk memperkuat konsep kimia. Kemudian tanyakan pada guru jika ada materi yang belum 'dipahami ya chemist!

Pergeseran Kesetimbangan
Asas Le Chatelier menyatakan: “Bila pada sistem kesetimbangan diadakan aksi, maka sistem akan mengadakan reaksi sedemikian rupa, sehingga pengaruh aksi itu menjadi sekecil-kecilnya”. Perubahan dari keadaan kesetimbangan semula ke keadaan kesetimbangan yang baru akibat adanya aksi atau pengaruh dari luar itu dikenal dengan pergeseran kesetimbangan (Martin S. Silberberg, 2000). Faktor yang dapat memengaruhi pergeseran kesetimbangan yaitu perubahan konsentrasi salah satu zat, perubahan tekanan dan volume, dan perubahan suhu.
1. Perubahan Konsentrasi
Apabila dalam sistem kesetimbangan, konsentrasi salah satu zat diperbesar, maka kesetimbangan akan bergeser ke arah yang berlawanan dari zat tersebut. Sebaliknya, jika konsentrasi salah satu zat diperkecil, maka kesetimbangan akan bergeser ke pihak zat tersebut. Bila zat diencerkan dengan menambah air pada sistem, maka kesetimbangan bergeser pada jumlah molekul terbanyak.
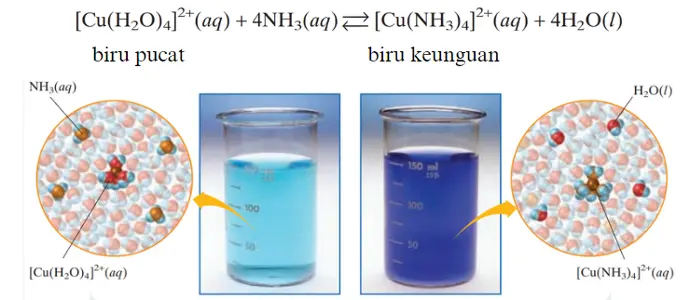
Jika kita menambahkan jumlah konsentrasi reaktan, maka sistem kesetimbangan akan bereaksi dengan menurunkan konsentrasi reaktan dengan mengubah sebagian reaktan menjadi produk sehingga kondisi kesetimbangan dapat kembali. Reaksi yang terjadi adalah reaksi maju atau ke arah produk sehingga reaksi bergeser ke arah kanan (ke arah produk). Begitupun dengan reaksi di atas, jika amonia ditambahkan dalam reaksi maka sisten akan mengimbangi dengan pembentukan produk yang lebih banyak. Pada warna larutan akan terlihat warna biru-keunguan yang lebih pekat. Berlaku kebalikannya, jika konsentrasi reaktan dikurangi atau pada reaksi di atas dikurangi gas amonia yang digunakan, maka sistem akan merespon dengan mengubah kembali produk menjadi reaktan untuk kembali mencapai kesetimbangan. Reaksi akan bergeser ke arah kiri atau ke arah reaktan. Pada warna larutan akan terlihat warna biru lebih pudar. Hal yang sama akan terjadi pada penambahan atau pengurangan konsentrasi zat pada produk. Akan tetapi, perlu diingat bahwa perubahan konsentrasi ini tidak merubah nilai tetapan kesetimbangan.
2. Perubahan Tekanan dan Volume
Jika dalam suatu sistem kesetimbangan dilakukan aksi yang menyebabkan perubahan volume (bersamaan dengan perubahan tekanan), maka dalam sistem akan mengadakan reaksi berupa pergeseran kesetimbangan sebagai berikut.
1. Jika tekanan diperbesar (volume diperkecil), maka kesetimbangan akan bergeser ke arah jumlah koefisien reaksi kecil.
2. Jika tekanan diperkecil (volume diperbesar), maka kesetimbangan akan bergeser ke arah jumlah koefisien reaksi besar.
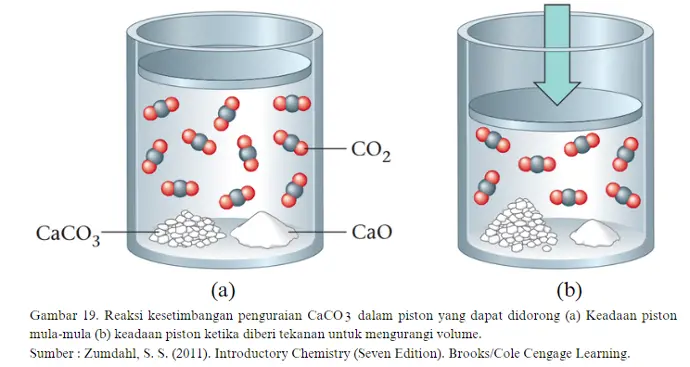
Jika piston didorong hingga volume berkurang, maka tekanan gas CO2 akan meningkat. Sistem akan melakukan pergeseran ke arah kiri dengan pembentukan reaktan untuk mengurangi jumlah gas yang ada sehingga sistem kembali mencapai kesetimbangan. Gas CO2 akan dikurangi dengan diubah menjadi reaktan kembali sehingga tekanan akan turun (Semakin sedikit molekul CO2 yang menabrak dinding piston karena gas CO2 menabrak CaO dan bergabung membentuk CaCO3 padat.
3. Perubahan Suhu
Menurut Van’t Hoff:
1. Bila pada sistem kesetimbangan suhu dinaikkan, maka kesetimbangan reaksi akan bergeser ke arah yang membutuhkan kalor (ke arah reaksi endoterm).
2. Bila pada sistem kesetimbangan suhu diturunkan, maka kesetimbangan reaksi akan bergeser ke arah yang membebaskan kalor (ke arah reaksi eksoterm).

Reaksi di atas merupakan reaksi endoterm. Pada reaksi endoterm, peningkatan suhu akan menyebabkan reaksi maju lebih disukai sehingga pergeseran kesetimbangan ke arah produk atau ke kanan. Jika dilihat pada gambar 20, ketika pemanasan akan terbentuk warna biru sedangkan ketidka dilakukan penurunan suhu, warna larutan menjadi pink karena penurunan suhu pada reaksi endoterm menyebabkan pergeseran kesetimbangan ke arah pembentukan reaktan atau ke kiri.
Selain mempengaruhi pergeseran kesetimbangan, perubahan suhu juga dapat mempengaruhi tetapan kesetimbangan. Jika reaksi endoterm dinaikkan suhunya maka produksi produk reaksi semakin banyak dan reaksi yang tersisa semakin sedikit. Karena hal tersebut tetapan kesetimbangan juga semakin besar. Sedangkan pada reaksi eksoterm berlaku sebaliknya. Jika suhu diturunkan menyebabkan pergeserah ke arah kanan sehingga produksi produk dan pengurangan reaktan semakin banyak, tetapan kesetimbangan akan semakin besar.
Reaksi endoterm : Suhu meningkat (tetapan kesetimbangan semakin besar)
Suhu menurun (tetapan kesetimbangan semakin kecil)
Reaksi eksoterm : Suhu meningkat (tetapan kesetimbangan semakin kecil)
Suhu menurun (tetapan kesetimbangan semakin besar)