Konsep
Kesetimbangan Kimia
FASE ORIENTASI
Perhatikan timbangan sama lengan di samping. Timbangan dua lengan adalah alat yang digunakan untuk mengukur massa atau berat suatu benda. Dua lengan pada timbangan akan berada di posisi yang sama (tidak ada yang lebih tinggi atau lebih rendah) atau seimbang saat beban di kedua lengan sama yang menunjukkan massa di lengan kanan dan lengan kiri sama. Hal ini juga dapat dianalogikan sebagai kondisi setimbang dalam ilmu kimia. Namun, ketika satu sisi ditambah beban dengan berat tertentu, maka akan merusak keseimbangan sehingga sistem menjadi tidak seimbang. Prinsip keseimbangan neraca mirip dengan prinsip pada kesetimbangan kimia. Perbedaannya, kesetimbangan dalam kimia bersifat dinamis bukan statis seperti timbangan. Kesetimbangan statis dan kesetimbangan dinamis adalah dua konsep yang terkait dengan reaksi kimia dan sistem yang mencapai titik kesetimbangan. Apa perbedaan kesetimbangan statis dan kesetimbangan dinamis? Lalu apa itu kesetimbangan kimia?. Temukan jawabannya dengan mengikuti langkah-langkah berikut ini!

FASE POSE QUESTION
Buatlah pertanyaan mengenai konsep kesetimbangan kimia yang akan kalian selidiki jawabannya!
Contoh : Apakah kesetimbangan kimia juga hanya dapat dicapai ketika konsentrasi di kedua sisi sama?
FASE PLAN
Untuk dapat memecahkan pertanyaan pada fase orientasi, diperlukan suatu penyelidikan. Penyelidikan ini difokuskan untuk menemukan perbedaan kesetimbangan statis dan dinamis dalam suatu reaksi kimia. Percobaan yang akan dilakukan adalah pembakaran kertas dan pendidihan air dalam wadah tertutup.
1. Buatlah kelompok yang terdiri dari 5-6 siswa.
2. Buatlah rencana penyelidikan dimulai dari alat dan bahan serta langkah kerja penyelidikan.
3. Tanyakan pada gurumu jika menemukan kesulitan.
4. Setelah merumuskan rencana konsultasikan dengan guru kelas.
Untuk pembelajaran mandiri pemecahan pertanyaan proses penyelidikan dapat dilakukan dengan menonton video yang telah disediakan dalam website ini.
FASE EXECUTE
Dalam pembelajaran mandiri, tontonlah video berikut untuk dapat mengamati peristiwa pembakaran kertas dan pendidihan air.
Lakukan penyelidikan berdasarkan rencana yang telah dibuat pada fase sebelumnya. Pastikan rencana tersebut telah disetujui oleh guru pengajar. Tulis hasil pengamatannya pada lkpd yang disediakan pada fase analyze.

Pembakaran kertas adalah reaksi kimia yang melibarkan karbon yang ada dalam kertas dengan oksigen menghasilkan gas karbon dioksida.
Sedangkan pendidihan air merupakan reaksi kimia yang hanya melibatkan perubahan fase air dari cair ke gas, dan dari gas ke cari kembali jika wadah tertutup.
Untuk memudahkan proses penyelidikan, kerjakan pertanyaan-pertanyaan dalam fase execute pada LKPD pada fase analize
FASE ANALYZE
Lakukanlah analisis terhadap hasil penyelidikan yang sudah didapat. Tuliskan langkah kerjamu dari awal hingga akhir ke dalam LKPD berikut ini!
FASE PRESENT FINDING
1. Buatlah ppt berisi pertanyaan, penyelidikan, hasil analisis, dan kesimpulan. Lakukan pula perluasan materi mengenai jenis reaksi kimia berdasarkan arahnya dan jenis kesetimbangan berdasarkan fasenya.
2. Salah satu kelompok melakukan presentasi di depan kelas
3. Kerjakan latihan-latihan soal berupa games di bagian bawah page ini dan klik back to course untuk latihan soal lainnya.

Kesetimbangan Kimia
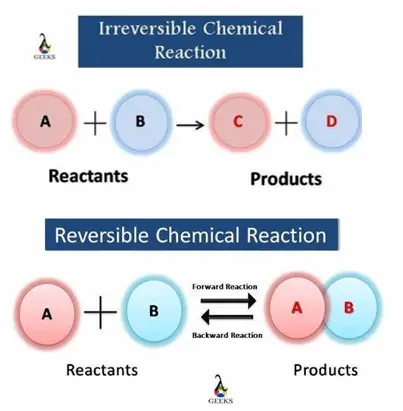
Tidak semua reaksi kimia dapat 100% menghasilkan produk. Ada sebagian reaksi kimia pada saat berlangsung, sejumlah produk yang dihasilkan bereaksi (terurai) kembali membentuk pereaksi. Oleh karena itu, berdasarkan arah reaksinya, reaksi kimia dibagi menjadi 2 yaitu :
1. Reaksi Irreversible (Tidak dapat balik). Reaksi satu arah (Irreversible) merupakan reaksi yang akan berhenti jika salah satu atau semua reaktan habis sehingga zat hasil reaksi tidak dapat dibentuk kembali (reaksi berhenti). Zat hasil reaksi juga tidak dapat bereaksi kembali membentuk pereaksi yang biasanya ditandai dengan tandar panah satu arah (→).
2. Reaksi Reversible (Dapat balik)
Reaksi dua arah (Reversible) adalah reaksi yang hasil reaksinya dapat membentuk kembali zat-zat pereaksi sehingga reaksi akan terus terjadi ke arah maju (pembentukan produk) dan mundur ( ke arah reaktan) yang ditandai dengan panah bolak balik (⇌). Reaksi inilah yang dapat mengalami keadaan setimbang.
Tontonlah video berikut dan bacalah penguatan untuk memperkuat konsep
kimia. Kemudian tanyakan pada guru jika ada materi yang belum '
dipahami ya chemist!
Apa itu kesetimbangan kimia?
Kesetimbangan kimia adalah keadaan pada suatu reaksi kesetimbangan. Reaksi kesetimbangan adalah reaksi reversible (dapat balik) yang dicapai ketika laju reaksi maju sama dengan laju reaksi mundur (Laju reaksi pembentukan produk sama dengan laju reaksi penguraian produk menjadi reaktan kembali) sehingga jumlah produk dan reaktan tetap. Contoh dari reaksi kesetimbangan yaitu :
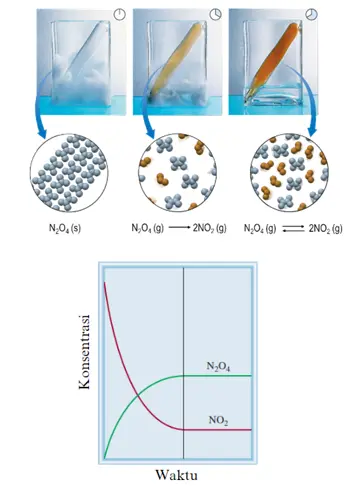
N2O4(g) ⇌ 2NO2(g)
Pada reaksi di atas, mula-mula N2O4 yang tak berwarna akan terurai membentuk NO2 yang berwarna coklat. Semakin lama reaksi terjadi, warna coklat akan semakin pekat hingga pada suatu keadaan warna coklat tidak mengalami perubahan lagi. Ketika warna coklat yang dihasilkan menjadi konstan, keadaan tersebut yang dinamakan keadaan setimbangan dimana konsentrasi masing-masing zat sudah tidak berubah.
Akan tetapi tidak semua reaksi kesetimbangan dapat mengalami perubahan warna ya chemist!.
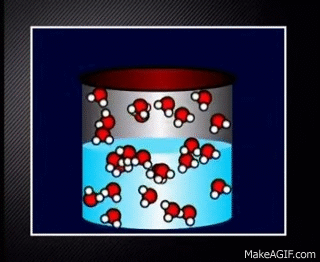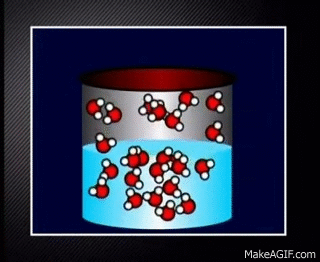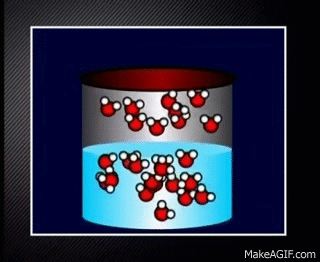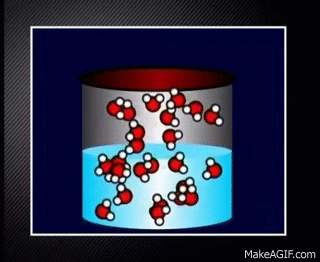
Contoh reaksi kesetimbangan yang tidak mengalami perubahan warna adalah yang chemist amati pada tahap sebelumnya. Yaps, pendidihan air pada wadah tertutup yang merupakan contoh kesetimbangan dinamis.
H2O(l) ⇌ H2O(g)
Meskipun tidak terlihat jelas perubahan dari cair menjadi gas dan sebaliknya belum tentu tidak terjadi reaksi ya chemist. Reaksi tetap berlangsung. Akan tetapi tidak terlihat secara makroskopis.
Simaklah video berikut untuk pemantapan konsep kesetimbangan kimiamu!
Berdasarkan fasenya, reaksi kesetimbangan dibagi menjadi dua yaitu :
1. Kesetimbangan Homogen
Kesetimbangan homogen adalah kesetimbangan pada reaksi yang memiliki fase zat dalam reaksi sama. Contoh :
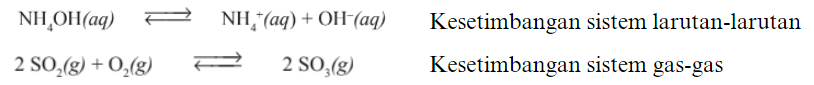
2. Kesetimbangan Heterogen adalah kesetimbangan pada reaksi yang fase zat dalam reaksinya berbeda. Contoh :
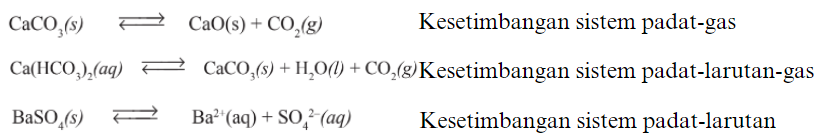
Kerjakan latihan soal singkat dalam game berikut untuk uji pemahaman.