Tetapan
Kesetimbangan Kimia
FASE ORIENTATION
Simaklah!
Menurut Cato Guldberg dan Waage, pada suhu tetap, harga tetapan kesetimbangan akan tetap. Hukum Cato Guldberg dan Waage berbunyi: “Dalam keadaan kesetimbangan pada suhu tetap, maka hasil kali konsentrasi zat-zat hasil reaksi dibagi dengan hasil kali konsentrasi pereaksi yang sisa di mana masing- masing konsentrasi itu dipangkatkan dengan koefisien reaksinya adalah tetap”. Coba perhatikan tabel di bawah :
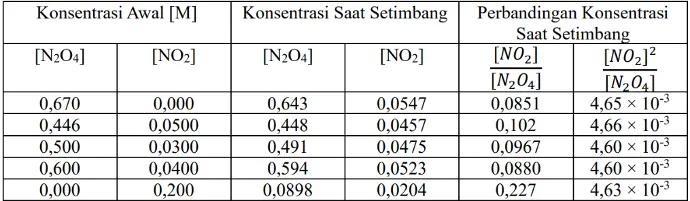
Persamaan reaksi :
N2O4 ⇌ 2NO2Pada tabel di atas, konsentrasi dinyatakan dalam molaritas. Perhatikan bahwa konsentrasi N2O4 dan NO2 saat setimbang sangat bervariasi tergantung pada kondisi awal reaktan. Hubungan konsentrasi N2O4 dan NO2 dapat diketahui dengan menghiung rasio konsentrasinya. Rasio [NO2] / [N2O4 ] memberikan nilai yang acak dan berbeda sedangkan rasio [NO2] /[N2O4 ] memberikan nilai yang hampir konstan terlepas dari nilai konsentrasi mula-mula yang berbeda. Rasio konstan ini yang kemudian dikenal dengan konstanta atau tetapan kesetimbangan.
FASE POSE QUESTION
Buatlah pertanyaan mengenai tetapan kesetimbangan kimia yang
akan kalian selidiki jawabannya!
FASE PLAN
1. Buatlah kelompok beranggotakan 4-5 orang
2. Diskusikan rencana penyelidikan untuk menjawab pertanyaan-pertanyaan setiap anggota kelompok dalam pose question. Penyelidikan dilakukan dengan kajian pustaka.
3. Tuangkan rencana penyelidikan dalam LKPD pada fase analyze.

FASE EXECUTE
Lakukanlah Penyelidikan dari pertanyaan-pertanyaan yang sudah dibuat. Kemudian kerjakan soal-soal pertanyaan pemantik pada fase execute di LKPD yang terdapat di fase analyze untuk menambah pengetahuanmu.
Gunakan sumber belajar yang terpercaya dalam tahap penyelidikan. Gunakan juga bahan ajar yang ada di website ini.

FASE ANALYZE
Kerjakan LKPD di bawah ini untuk memudahkan proses analisis. Analisislah hasil penyelidikanmu terhadap pertanyaan dari setiap anggota kelompokmu dan pertanyaan pemantik yang disediakan.
FASE PRESENT FINDING
1. Buatlah ppt berisi pertanyaan, penyelidikan, hasil analisis, dan kesimpulan. Lakukan pula perluasan materi mengenai jenis reaksi kimia berdasarkan arahnya dan jenis kesetimbangan berdasarkan fasenya.
2. Salah satu kelompok melakukan presentasi di depan kelas
3. Lakukan diskusi dan tanya jawab antar kelompok
4. Kerjakan latihan-latihan soal dengan klik back to course untuk latihan soal lainnya.
Tontonlah video berikut dan bacalah penguatan untuk memperkuat konsep kimia. Kemudian tanyakan pada guru jika ada materi yang belum dipahami ya chemist!

Tetapan Kesetimbangan
Sains adalah ilmu yang didasarkan pada hasil eksperimen. Begitu juga dengan hukum tetapan kesetimbangan kimia. Hukum kesetimbangan kimia pertama kali diusulkan oleh Maximilian Guldberg dan Peter Waage pada tahun 1864 sebagai gambaran umum kondisi kesetimbangan (awalnya disebut hukum aksi massa). Postulat Guldberg dan Waage yaitu, pada jenis reaksi :
aA + bB ⇌ cC + dD
dimana A, B, C, dan D mewakili spesies kimia dan a,b,c, dan d mewakili koefisien dari spesies kimia dalam keadaan setimbang. Hukum aksi diwakili oleh persamaan kesetimbangan atau lebih familiar disebut equilibrium expression sebagai berikut:
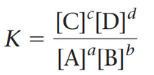
Kesetimbangan Berdasarkan Konsentrasi (Kc)
Tetapan kesetimbangan berdasarkan konsentrasi zat (Kc) menggunakan nilai molaritas zat (M). Untuk menghitung nilai tetapan kesetimbangan, perlu diperhatikan fasa zat dalam reaksi kesetimbangan. Nilai tetapan kesetimbangan konsentrasi (Kc) memperhitungkan konsentrasi zat yang berfase gas(g) dan larutan(aq) . Jika zat dalam reaksi berfasa cair(l) dan padat(s) maka konsentrasi zat tersebut diabaikan (tidak dinyatakan dalam konstanta kesetimbangan). Hal tersebut dikarenakan konsentrasi suatu zat padat memiliki sifat yang intensif dan tidak bergantung seberapa banyak zat tersebut berada (zat padat selalu memiliki densitas yang sama). Begitupula dengan zat cair murni yang selalu memiliki densitas yang sama. Sehingga konsentrasi keduanya dianggap konstan.
Konstanta kesetimbangan ditentukan dari hasil bagi dari konsentrasi kesetimbangan produk dipangkatkan koefisien pada konsentrasi kesetimbangan reaktan dipangkatkan koefisien stoikiometri. Jika nilai K lebih besar dari 1 (>1) maka kesetimbangan akan cenderung ke arah kanan atau ke arah produk sehingga produk yang dihasilkan lebih banyak. Jika nilai K lebih kecil dari 1 (K<1) kesetimbangan akan cenderung ke arah kiri atau ke arah pembentukan reaktan. Rumus tetapan kesetimbangan untuk reaksi umum aA + bB ⇌ cC + dD yaitu :
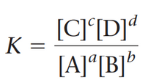
Dengan a, d, c, dan d adalah koefisien stoikiometri saat kesetimbangan.
Kesetimbangan Berdasarkan Tekanan Parsial
Tetapan kesetimbangan berdasarkan tekanan parsial (Kp) berdasarkan dari tekanan parsial zatnya. Untuk menghitung nilai tetapan kesetimbangan, perlu diperhatikan fasa zat dalam reaksi kesetimbangan. Nilai tetapan kesetimbangan tekanan (Kp) memperhitungkan konsentrasi zat yang berfase gas(g) saja. Jika zat dalam reaksi berfasa cair(l), larutan(aq) dan padat(s) maka konsentrasi zat tersebut diabaikan. Hal tersebut dikarenakan hanya fase gas yang dapat dinyatakan dalam bentuk tekanan parsial.
Tetapan kesetimbangan berdasarkan tekanan parsial gas merupakan hasil kali tekanan parsial gas hasil reaksi dibagi tekanan parsial gas-gas pereaksi yang masing-masing dipangkatkan koefisien. Rumus tetapan kesetimbangan untuk reaksi umum aA + bB ⇌ cC + dD yaitu :
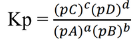
Dengan : Kp = Tetapan kesetimbangan berdasarkan tekanan, pA= tekanan parsial A, pB= tekanan parsial B, pC = tekanan parsial C, dan pD= tekanan parsial D
Hubungan Kc dan Kp
Nilai Kp dapat ditentukan berdasarkan nilai Kc dengan rumus :
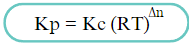
Dengan nilai R = Tetapan gas ideal (0,082 L.atm/mol.K) , T = suhu (K), dan ∆n = Koefisien gas produk (ruas kanan) - koefisien gas reaktan (ruas kiri).
Jika koefisien gas ruas kanan = koefisien gas ruas kiri maka ∆n=0 sehingga nilai Kp = Kc
Pengaruh Suhu terhadap Nilai Tetapan Kesetimbangan
Nilai tetapan kesetimbangan hanya dipengaruhi oleh perubahan suhu. Nilai tetapan kesetimbangan tidak dipengaruhi oleh perubahan konsentrasi, perubahan volume/tekanan, ataupun oleh katalis. Katalis hanya membantu
mempercepat tercapainya kesetimbangan tanpa memengaruhi nilai tetapan kesetimbangan.
Pada reaksi endoterm (∆H= +) saat suhu naik nilai K bertambah.
Pada reaksi eksoterm (∆H= -) saat suhu naik nilai K berkurang.
Membandingkan Tetapan Kesetimbangan
- Ketika persamaan reaksi reversible dituliskan dengan arah yang berlawanan, maka nilai tetapan kesetimbangan menjadi kebalikan dari konstanta kesetimbangan asal.
K'=1/K
- Jika persamaan reaksi dikalikan x, maka tetapan kesetimbangan dipangkatkan x.
K'= K^x
- Jika persamaan reaksi dibagi x, maka tetapan kesetimbangan diakar x.
K' = KVx
- Jika dua atau lebih reaksi dijumlahkan, maka tetapan kesetimbangan masing-masing reaksi dikalikan. (Nilai K dikalikan)